原子 の 電子 配置 - 電子配置
NHK高校講座
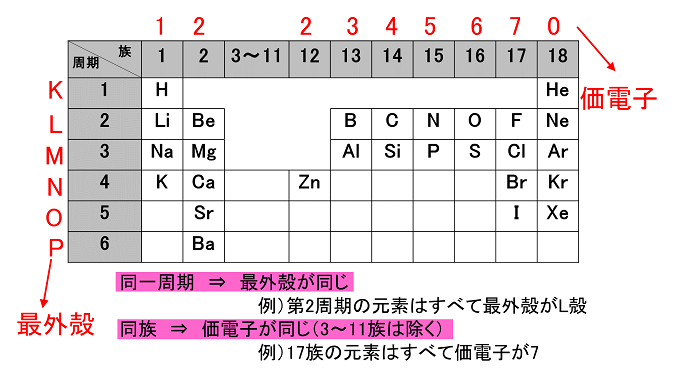
それを電子配置という。
4f電子、5f電子が存在する。
11 以前の熱化学方程式の記事には、 かなりの人が興味を持ってくれたようです。
例えば、主量子数2、方位量子数1の軌道を総称して2p軌道と呼ぶ。
電子配置
これで窒素の持つ7個の電子全てが収まったので完成です。
これは、希ガス原子の電子配置が非常に安定しているためである。
遷移元素が生じるのはd軌道のせいで起こる現象でしたが、「 ランタノイド」や「 アクチノイド」はf軌道のせいで生じてきます。
2018. なぜ1つの軌道に2つの電子? 実は電子には「 アップスピン」と「 ダウンスピン」という2つの種類があります。
原子と原子核の構造をわかりやすく図解してみた
これでカルシウムの持つ20個の電子全てが収まったので完成です。
原子番号19のカリウム K と20のカルシウム Ca についてはルール3で解説。
電子配置の決まり方 それでは実際に電子配置を見ていきましょう。
K殻に入れることができる電子は2個までです。
【図解】電子配置の書き方の解説と電子配置の一覧(周期表)
ステップ2:L殻に残りの4個の電子を埋める 6個のうちのK殻の2個以外の電子をL殻に収容します。
僕は地方公立高校から東大に合格した経験から 勉強に関する記事を作っています。
また、フッ素の場合、上の図のようにK殻に2個、L殻に7個電子が存在しています。
ここに突入すると、大幅に受験化学を逸脱します。
原子構造と電子配置・価電子
このようにして、 21Sc:1s 22s 22p 63s 23p 64s 23d 1 もしくは、 21Sc:[Ar]4s 23d 1 と詰まっていきます。
実はこれこそが「 遷移元素」が存在する理由です。
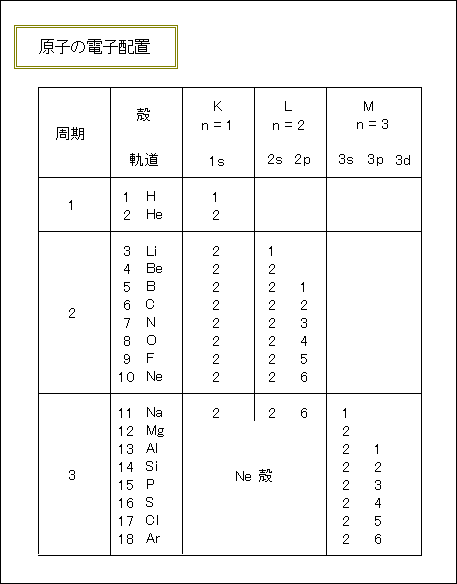
原子の電子配置表 原子番号 元素 電子殻 K L M N O P Q 電子軌道 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 1 H 1 2 He 2 3 Li 2 1 4 Be 2 2 5 B 2 2 1 6 C 2 2 2 7 N 2 2 3 8 O 2 2 4 9 F 2 2 5 10 Ne 2 2 6 11 Na 2 2 6 1 12 Mg 2 2 6 2 13 Al 2 2 6 2 1 14 Si 2 2 6 2 2 15 P 2 2 6 2 3 16 S 2 2 6 2 4 17 Cl 2 2 6 2 5 18 Ar 2 2 6 2 6 19 K 2 2 6 2 6 1 20 Ca 2 2 6 2 6 2 21 Sc 2 2 6 2 6 1 2 22 Ti 2 2 6 2 6 2 2 23 V 2 2 6 2 6 3 2 24 Cr 2 2 6 2 6 5 1 25 Mn 2 2 6 2 6 5 2 26 Fe 2 2 6 2 6 6 2 27 Co 2 2 6 2 6 7 2 28 Ni 2 2 6 2 6 8 2 29 Cu 2 2 6 2 6 10 1 30 Zn 2 2 6 2 6 10 2 31 Ga 2 2 6 2 6 10 2 1 32 Ge 2 2 6 2 6 10 2 2 33 As 2 2 6 2 6 10 2 3 34 Se 2 2 6 2 6 10 2 4 35 Br 2 2 6 2 6 10 2 5 36 Kr 2 2 6 2 6 10 2 6 37 Rb 2 2 6 2 6 10 2 6 1 38 Sr 2 2 6 2 6 10 2 6 2 39 Y 2 2 6 2 6 10 2 6 1 2 40 Zr 2 2 6 2 6 10 2 6 2 2 41 Nb 2 2 6 2 6 10 2 6 4 1 42 Mo 2 2 6 2 6 10 2 6 5 1 43 Tc 2 2 6 2 6 10 2 6 5 2 44 Ru 2 2 6 2 6 10 2 6 7 1 45 Rh 2 2 6 2 6 10 2 6 8 1 46 Pd 2 2 6 2 6 10 2 6 10 47 Ag 2 2 6 2 6 10 2 6 10 1 48 Cd 2 2 6 2 6 10 2 6 10 2 49 In 2 2 6 2 6 10 2 6 10 2 1 50 Sn 2 2 6 2 6 10 2 6 10 2 2 51 Sb 2 2 6 2 6 10 2 6 10 2 3 52 Te 2 2 6 2 6 10 2 6 10 2 4 53 I 2 2 6 2 6 10 2 6 10 2 5 54 Xe 2 2 6 2 6 10 2 6 10 2 6 55 Cs 2 2 6 2 6 10 2 6 10 2 6 1 56 Ba 2 2 6 2 6 10 2 6 10 2 6 2 57 La 2 2 6 2 6 10 2 6 10 2 6 1 2 58 Ce 2 2 6 2 6 10 2 6 10 1 2 6 1 2 59 Pr 2 2 6 2 6 10 2 6 10 3 2 6 2 60 Nd 2 2 6 2 6 10 2 6 10 4 2 6 2 61 Pm 2 2 6 2 6 10 2 6 10 5 2 6 2 62 Sm 2 2 6 2 6 10 2 6 10 6 2 6 2 63 Eu 2 2 6 2 6 10 2 6 10 7 2 6 2 64 Gd 2 2 6 2 6 10 2 6 10 7 2 6 1 2 65 Tb 2 2 6 2 6 10 2 6 10 9 2 6 2 66 Dy 2 2 6 2 6 10 2 6 10 10 2 6 2 67 Ho 2 2 6 2 6 10 2 6 10 11 2 6 2 68 Er 2 2 6 2 6 10 2 6 10 12 2 6 2 69 Tm 2 2 6 2 6 10 2 6 10 13 2 6 2 70 Yb 2 2 6 2 6 10 2 6 10 14 2 6 2 71 Lu 2 2 6 2 6 10 2 6 10 14 2 6 1 2 72 Hf 2 2 6 2 6 10 2 6 10 14 2 6 2 2 73 Ta 2 2 6 2 6 10 2 6 10 14 2 6 3 2 74 W 2 2 6 2 6 10 2 6 10 14 2 6 4 2 75 Re 2 2 6 2 6 10 2 6 10 14 2 6 5 2 76 Os 2 2 6 2 6 10 2 6 10 14 2 6 6 2 77 Ir 2 2 6 2 6 10 2 6 10 14 2 6 7 2 78 Pt 2 2 6 2 6 10 2 6 10 14 2 6 9 1 79 Au 2 2 6 2 6 10 2 6 10 14 2 6 10 1 80 Hg 2 2 6 2 6 10 2 6 10 14 2 6 10 2 81 Tl 2 2 6 2 6 10 2 6 10 14 2 6 10 2 1 82 Pb 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 83 Bi 2 2 6 2 6 10 2 6 10 14 2 6 10 2 3 84 Po 2 2 6 2 6 10 2 6 10 14 2 6 10 2 4 85 At 2 2 6 2 6 10 2 6 10 14 2 6 10 2 5 86 Rn 2 2 6 2 6 10 2 6 10 14 2 6 10 2 6 87 Fr 2 2 6 2 6 10 2 6 10 14 2 6 10 2 6 1 88 Ra 2 2 6 2 6 10 2 6 10 14 2 6 10 2 6 2 89 Ac 2 2 6 2 6 10 2 6 10 14 2 6 10 2 6 1 2 90 Th 2 2 6 2 6 10 2 6 10 14 2 6 10 2 6 2 2 91 Pa 2 2 6 2 6 10 2 6 10 14 2 6 10 2 6 3 2 92 U 2 2 6 2 6 10 2 6 10 14 2 6 10 3 2 6 1 2 93 Np 2 2 6 2 6 10 2 6 10 14 2 6 10 4 2 6 1 2 94 Pu 2 2 6 2 6 10 2 6 10 14 2 6 10 6 2 6 2 95 Am 2 2 6 2 6 10 2 6 10 14 2 6 10 7 2 6 2 96 Cm 2 2 6 2 6 10 2 6 10 14 2 6 10 7 2 6 1 2. 電子は内側から順にK殻,L殻,M殻,N殻. ルール1. M殻は18個まで電子を入れることができるけど、 RULE2より 最外殻電子(=最も外側の電子殻に存在する電子)は8個を超えてはいけないので次の殻にいく。
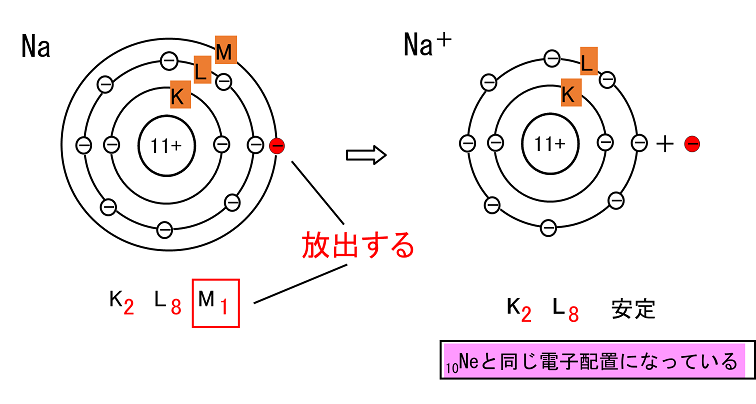
たとえばマグネシウムの原子番号は12なので、陽子の数も12個、そして電子の数もそれと同じ12個です。
原子構造と電子配置・価電子
残りの2個がどこにいくのかは次のSTEP5を見てみよう。
電子を1個取り出して、貴ガスと同じ電子配置になった方が、中性でいるよりも安定である。
ケン 「どうして いろいろな色があるのですか?」 今井先生 「先ほど分光器で見た赤い線は、電子がM殻からL殻へ落ちるときに放出されます。
しかし電子配置は、 少しハイレベルなところまで覚えておくことをおすすめします。
原子構造と電子配置・価電子
応用:軌道の形 いままで軌道という言葉は、 「電子殻と同じで電子が入る場所のこと」 と説明してきました。
つまりp軌道を3つ合わせると、 3方向、6つの向きに手を伸ばしているということになります。
STEP1 炭素同様、まずは内側のK殻に2個の電子が入る。
1 電子配置とは? 電子が電子殻に入るとき、その入り方には規則性があります。
- 関連記事
2021 tmh.io
![の 配置 原子 電子 [4つ覚えるだけ] 電子配置の書き方 の 配置 原子 電子 原子と原子核の構造をわかりやすく図解してみた](https://staff.aist.go.jp/a.ohta/image/REE/orb_3d_Cu.gif)

![の 配置 原子 電子 原子と原子核の構造をわかりやすく図解してみた の 配置 原子 電子 [4つ覚えるだけ] 電子配置の書き方](https://cdn.clearnotebooks.com/uploads/qa_answer_image/file/67528/2C05847B-4A02-4F38-B803-B06332341A3E.jpg)
![の 配置 原子 電子 [4つ覚えるだけ] 電子配置の書き方 の 配置 原子 電子 原子の電子配置表](https://kimika.net/wp-content/uploads/2017/08/densihaichi3-300x300.png)