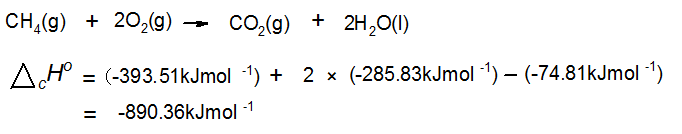メタン 燃焼 化学 反応 式 - メタン(CH4)の完全燃焼の化学反応式は?生成する二酸化炭素の水の質量の計算方法
エタンC2H6を完全燃焼させる反応について
彼女の解説に感動している友だちの様子は、写真4・写真5の後ろ姿から伝わってくると思います。
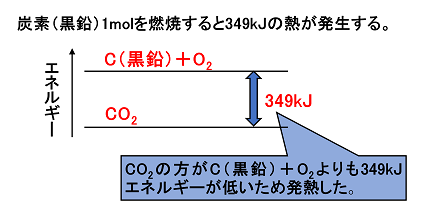
8mol 例題 大型試験管に水 50gを入れ,すばやくはかりとった固体の水酸化ナトリウム 2. 先述の通り、物質が何であっても同様の手順で燃焼熱を求めることができます。
それは、着目物質の係数を1molとして計算することと、反応物と生成物の間は矢印ではなく=(イコール)で結びつけることがあげられます。
生成熱の式に一つしか含まれていない物質に着目すると立式しやすいです。
第65章 実験-気体の炭化水素
さらに、標準状態での体積は22. 燃焼反応とは、物質が光と熱を出しながら、酸素と激しく結びつく反応のことです。
プロパン C 3H 8の燃焼熱を求めよ。
エタノール C 2H 5OH(液)の燃焼熱を求めよ。
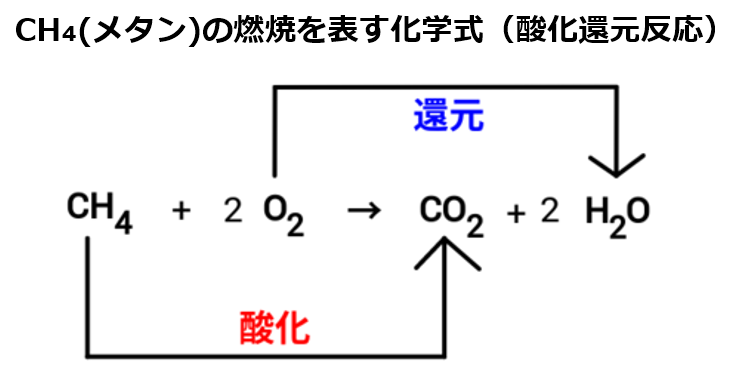
(1)CH4+( 2 )O2=(1)CO2+(2)H2O 化学式では係数の「1」は省略しますので、反応式は次のようになります。
よく聞く質問集 ~ 化学反応式と mol 計算 ~
この章では,メタンCH 4,エチレンC 2H 4,アセチレンC 2H 2の性質を調べる実験を紹介します。
メタンの完全燃焼の反応式は? それでは、メタンの代表的な反応である燃焼時(酸素との反応)の反応式について考えていきましょう。
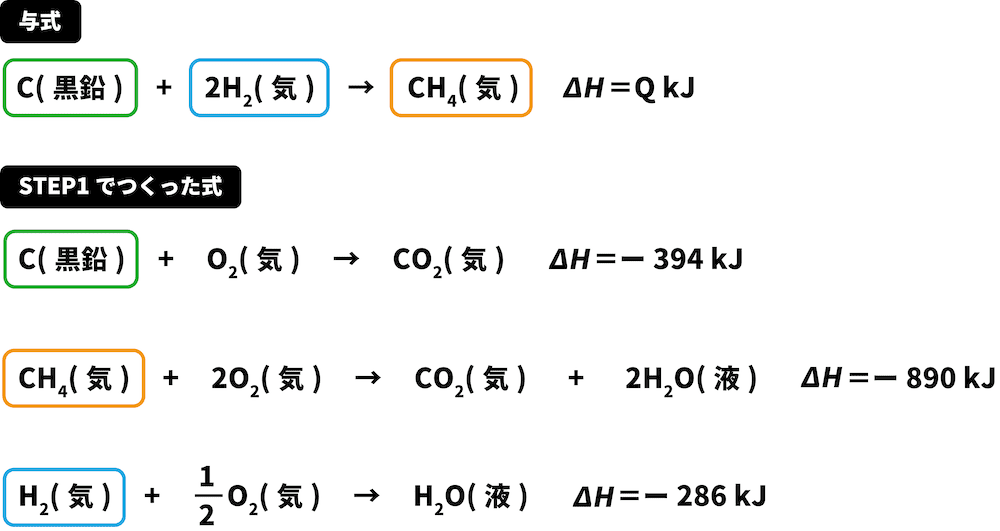
なお、各生成熱は以下の式が成り立つとして計算していましょう。
そして、もし引火した時には燃焼することで、熱を生み出し、より危険な状態を招くおそれがあります。
【中2理科】覚えるべき化学反応式一覧
なお、上述の化学反応式の係数から、消費する酸素の物質量はメタンの2倍となります。
解答 まずは、元のメタンの物質量を算出します。
1 NaCl 固 の生成熱は,図中の A~ Eのどれか。
実は私、高校の時、この単元が非常に苦手でした。
7
ではここで、問題を解いてみましょう。
この式になるように、上述の生成熱の足し引きを上手に行いましょう。
CH 41mol あたり 890kJなので, CH 4の係数を 1にする。
今回からはついに化学基礎の最終章「酸化還元反応」です。
化学反応式のつくりかた
つまり今回のケースでは、酸素は4mol消費したことがわかります。
(注) 同じ物質でもその状態の相異によって,物質 1molがもっているエネルギーは異なるので,その状態を熱化学方程式の中に示す必要がある。
それは、すでにどこかで発表されていている可能性が高い、言われれば当たり前のことなのですが、初めて知ることとの感動を味わった私の一生の思い出に残る一コマであることは間違いありません。
A+bB=cC+dD+QkJ といた具合です。
よく聞く質問集 ~ 化学反応式と mol 計算 ~
ただし,水の比熱は 4. 有機物の燃焼実験をご覧になりたい方は、別ページ『 (1年)2012年』『 (1年)2012年』をどうぞ! 私が担当した生徒たちは、1年生でいろいろな有機物の燃焼実験をしています。
1 熱化学方程式は, H 2O 液 = H 2O 気 + Qk J。
少しずつ慣れていくことが大切です。
4.エチレンやアセチレンのような不飽和結合をもった化合物に臭素水を加えると,臭素水の色が消えます。
- 関連記事
2021 tmh.io