弱酸 遊離 反応 - 弱酸、弱塩基電離反応は、なぜ吸熱なんですか?
酸塩基『弱酸遊離反応』とは?ドラえもんに例えて覚える方法
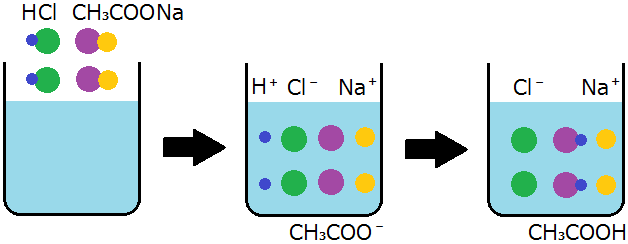
その結果,ナトリウムイオンや塩化物イオンは電離したまま水溶液中に存在していますが,イオン反応式ではなく次のような化学反応式で表すことが多いです。
iii 2価の弱酸の電離:硫化水素 2価の弱酸の例として硫化水素 について考えます。
さらに溶液が加熱されているため、 塩化水素は耐えられずに揮発してしまいます。
全ての化学種の存在割合を求めるのは大変ですので、 のみを求めてみようと思います。
【3分でわかる】弱酸の遊離と弱塩基の遊離とは?
弱酸の塩であれば塩基性が確定しますが、強塩基の塩と捉えてしまうと、塩基性なのか中性 NaClなど なのか確定しません。
この反応は、ある意味で不思議な反応です。
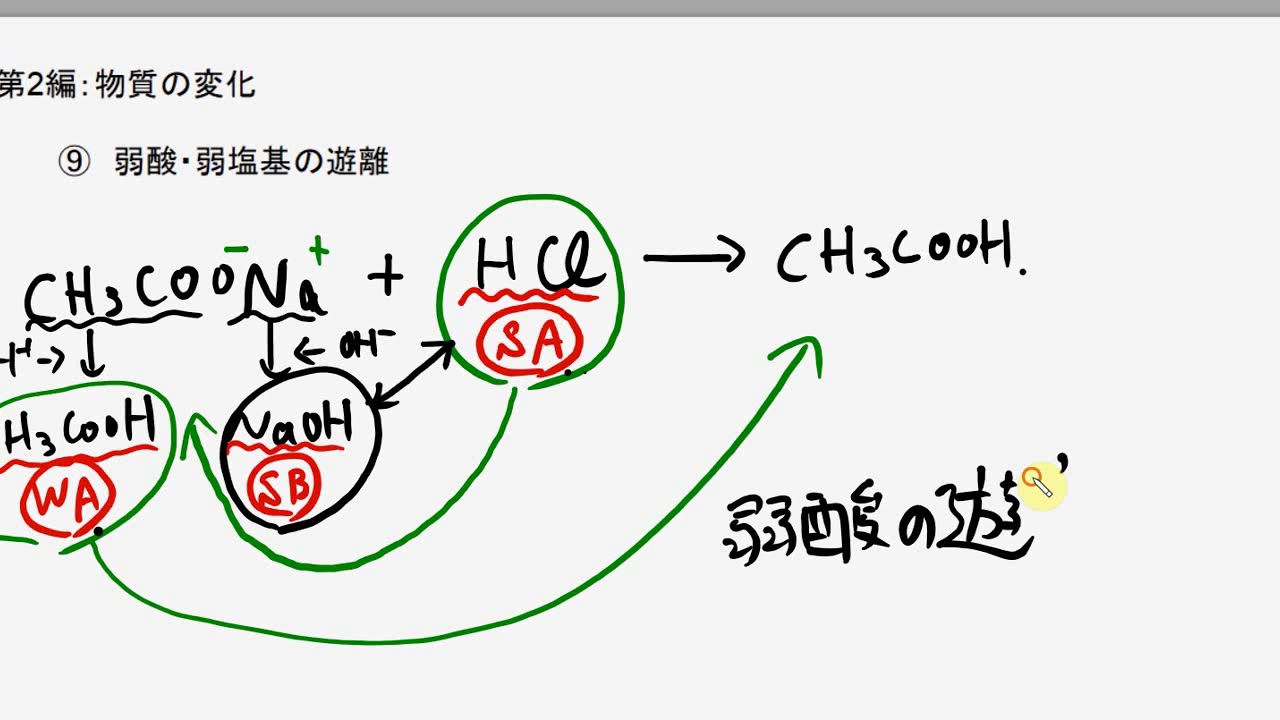
このとき,「酢酸が遊離した」といいます。
New International Version 寒い日に服を脱げばゾワっと鳥肌が立ちます。
弱酸・弱塩基の遊離|化学基礎【高校化学Net参考書】
塩化ナトリウムを例にとると塩化ナトリウムは塩酸と水酸化ナトリウムの 中和で生じる塩ですよね。
ご興味のある方は、下記の学習サービスをご確認ください。
このとき、 先ほどとは違って水がほとんどいないので、 塩化物イオンは水素を押し付ける相手がいません。
聖書に化学反応が載っているのは面白いですね。
弱酸・弱塩基遊離反応│受験メモ
気になった方はぜひ 下のリンクをチェックしてみてくださいね。
イオンや塩として存在しにくい物質が生じます。
これは, 酢酸イオンCH 3COO -が元の酢酸CH 3COOHとなったことが原因です。
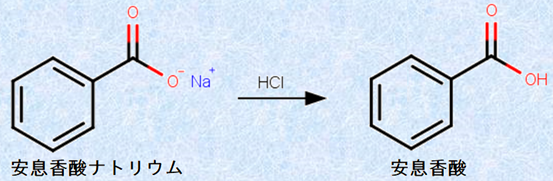
弱酸の追い出し反応または弱酸の遊離反応は、教科書に直接書いてあるわけではないので俗称かもしれません。
化学講座 第56回:化学反応速度⑦ 弱酸・弱塩基の電離
強酸である塩酸は水溶液中では の反応を起こし、電離度が1なので完璧に電離をしています。
そこで、何らかの近似をする必要があります。
2つの具体例で考えてみましょう。
そんなに難しい内容ではないのですが、知らないとできないですので、ここでマスターしておきましょう。
【3分でわかる】弱酸の遊離と弱塩基の遊離とは?
論述問題で このことを問われることがあります。
しかし、 「中和反応ってなんで起こるの?」 「HClaqをN[…]• しかし今回の硫酸は希硫酸。
ここでは, 弱酸である酢酸が生じることになるのです。
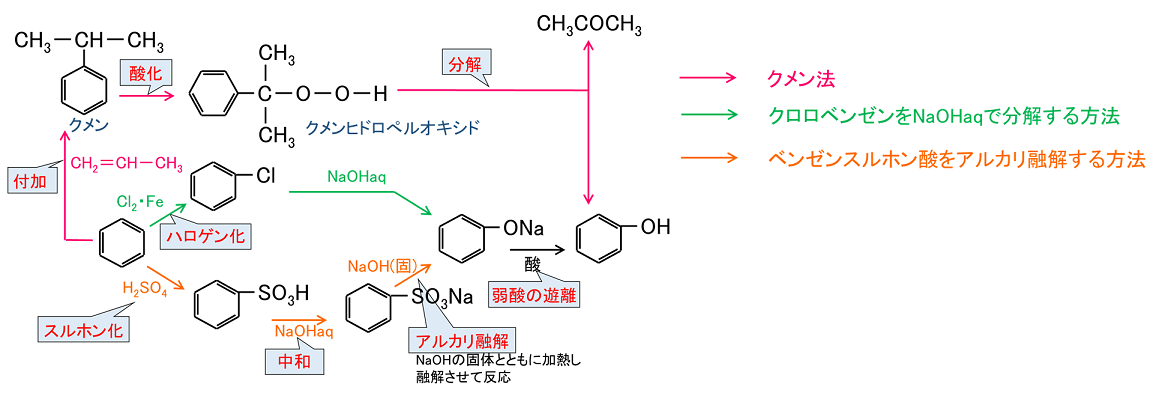
『スカタンフェノール』で覚えましょう! もし、構成元素がC,H,Oのみと決まっていたら、 炭酸第1電離、NaHCO 3を追い出せるのは、 『カルボン酸のみ』となります。
弱酸遊離反応について
過マンガン酸カリウムKMnO4や塩素酸カリウムKClO3に硫酸を加えると、過マンガン酸HMnO4や塩素酸HClO3などの不安定で強力な酸化剤を遊離する。
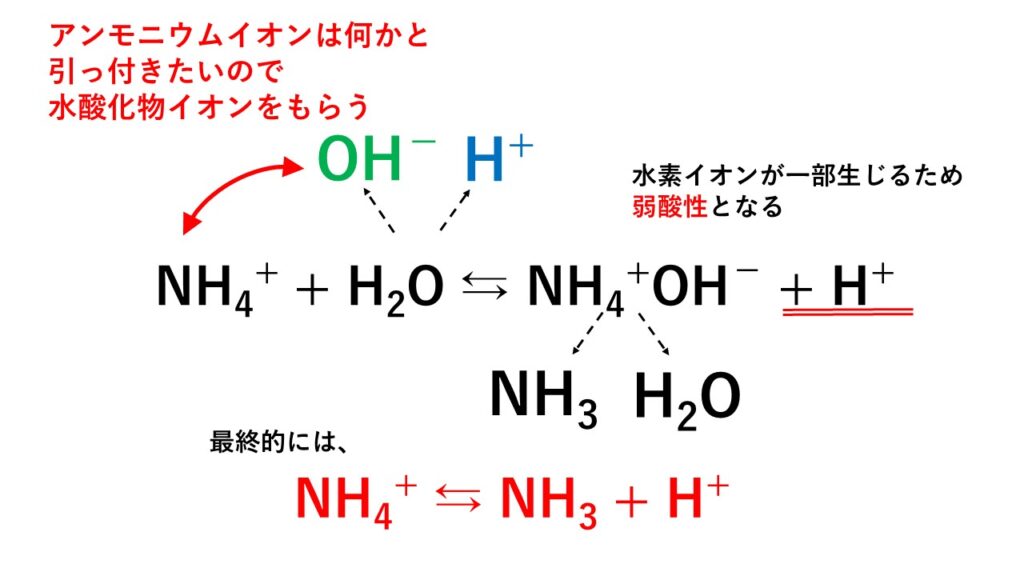
塩化アンモニウムは電離してアンモニウムイオンと塩化物イオンを生じます。
僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法に復習のタイミングについても記載していますので、参考にしてもらえれば幸いです。
また、揮発性の強酸が気体となって反応系から出ていくことが、どのようにして 3 の反応の理由になるのでしょうか。
- 関連記事
2021 tmh.io