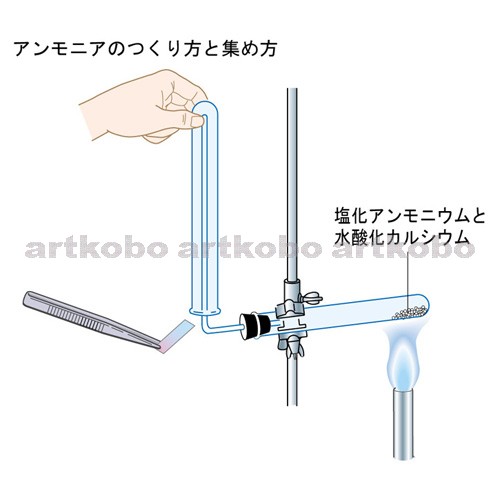
塩化 アンモニウム と 水 酸化 カルシウム - 主な化学反応式一覧−中学理科で登場する化学反応式のまとめ|教科書をわかりやすく通訳するサイト
塩化アンモニウムと水酸化カルシウムを混ぜそれを加熱するとアンモニア水...
その際、塩化ナトリウムが 塩 えんとして生成される。
回答お願いします。
酸化の中でも、熱や光を発しながら激しく酸化することを燃焼という。
スポンサーリンク 強酸と強塩基の塩 塩化ナトリウムのような 強酸と強塩基の塩(塩化水素と水酸化ナトリウムの塩)は,陰イオン,陽イオンともに水素イオンや水酸化物イオンと反応せず, 加水分解しません。
塩化 アンモニウム と 水 酸化 カルシウム
用途 [ ] であるが、指定を受けていないため、酸性化したや土壌の中和剤、凝集剤として幅広く使われる。
中和反応として考えるのであればNH4+からOH-にH+が移っていますからNH4+が酸、OH-が塩基であるとすればいいです。
なお、石灰水は水酸化カルシウムの水溶液です。
の凝固剤としても使用されている。
塩の加水分解|化学基礎【高校化学Net参考書】
は水酸化カルシウムを主成分とする建築材料である。
このとき, 水素イオンが減少するので,塩基性へと変化します。
強酸は,ほぼすべてが電離して単独のイオンとして存在してやすいからです。
イオン反応式で考えてみてください。
塩の加水分解|化学基礎【高校化学Net参考書】
もちろん加水分解しません。
そもそも、何で固体同士の反応が主な製法として選ばれたのでしょうか? 塩化アンモニウムは水に溶けるし、 水酸化カルシウムは水に少ししか溶けないけどここで問題なのは強塩基であることなのですから、(弱塩基の遊離) どちらも水溶液の状態にして混合してもいいんじゃないでしょうか? その方が、試験管の破損などを心配する必要もないと思うのですが。
特にに入った場合は・結膜に障害を起こすことがあるので、速やかに流水で十分に洗眼し、緊急に眼科医の診察を受けるべきである。
これは生成する炭酸カルシウムが水に難溶性であるためである。
化学反応式 Hello School 中学理科(ハロ理科)
水酸化カルシウムは強塩基であり、微生物の繁殖を抑制したり不活性化する性質がある。
そのため、小中学校などでは校庭に白線を引くとして用いられていたが、2007年11月にスポーツ・青少年局学校健康教育課長名で通達 が出されたこともあり、白線用としては、より安全なに変更されている。
このとき, 水酸化物イオンが減少するので,酸性へと変化します。
例えば、 塩化アンモニウムと 水酸化バリウム や水酸化ナトリウム でもアンモニア は発生します。
塩化アンモニウムと水酸化カルシウムを混ぜそれを加熱するとアンモニア水...
では,どのようにして水溶液の液性が判断できるのでしょうか。
逆にいうと金属の水酸化物で強塩基は水によく溶けるものです。
消石灰(しょうせっかい)とも呼ばれる。
ソルベイ法 製品一覧 製品名 試薬特級 試薬特級 試薬特級 ひ素分析用 試薬特級 ひ素分析用 ひ素分析用 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 医薬品試験用 試薬特級 試薬特級 試薬特級 試薬特級 オキシダント測定用 試薬特級 電気伝導率測定用 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 医薬品試験用 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 ひ素分析用 医薬品試験用 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 元素分析用 元素分析用 元素分析用 試薬特級 試薬特級 試薬特級 試薬特級 窒素・りん測定用 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級 試薬特級. その結果,液性は酸性となります。
- 関連記事
2021 tmh.io