アンモニア 混成 軌道 - かがくののおと
軌道の混成
高校生などで学ぶ電子軌道の考え方とまったく違うため、混乱する人が非常に多いという理由があります。
. 電子が存在する確率であるため、場合によっては電子軌道の中に電子が存在しないこともあります。
メチルアニオンはCH3-のことです。
. エステルの日本語の命名法は酸の名前に続けて、アルコールをアルキル基に変えたものを続けて読みます。
【文系女子が教える化学】混成軌道はなぜ起こる?混成軌道の基本まとめ
Fischer投影式の考え方としては、上下左右を回転させて合わせてから書く必要があります。
電気陰性度、イオン化エネルギー、電子親和力は一般的に周期表の右上に行くほど強いです。
早速例題を見ていきましょう。
化学結合には、イオン結合、金属結合、共有結合などの種類があります。
N原子のsp3混成軌道について教えてください.
大部分の分子は正三角錐に近い構造をとっているけど、ごく一部の分子は平面に近い構造をとっている、という見方の方が正確です。
以下のようなイメージを有している人がほとんどです。
ブタンにおいて安定性は、ねじれ形のアンチ形>ねじれ形のゴーシュ形>重なり形となります。
分かりやすく考えるため今までの説明では、それぞれの原子が有する手の数に着目してきました。
s軌道・p軌道と混成軌道の見分け方:sp3、sp2、spの電子軌道の概念
メソ体もラセミ体も光学不活性です。
共鳴構造はもっと複雑なので、より深い理解を目指します。
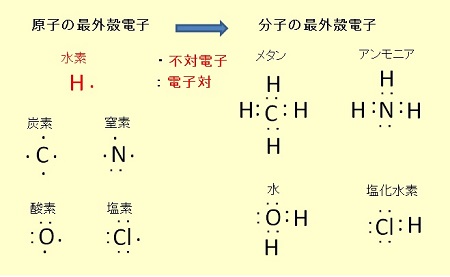
このように考えて非共有電子対まで含めると、アンモニアの窒素原子は4本の手が存在することが分かります。
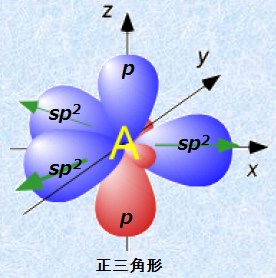
3本の手を伸ばす場合、これらは互いに最も離れた結合角を有するように位置します。
かがくののおと
カルボカチオンは電子供与基がつくと安定化し、電子求引基がつくと不安定となります。
より厳密にいうと、混成軌道とは分子の形になります。
カルボアニオンは電子求引基がつくと不安定化し、電子求引基がつくと安定化します。
異なる元素の混成軌道 メタンCH4、アンモニアNH3、水H2OのC、N、O はすべてsp3混成軌道で、正四面体構造です。
sp3混成軌道、sp2混成軌道、sp混成軌道例題編
こうした立体構造は混成軌道の種類によって決定されます。
着目する原子が異なれば、混成軌道の種類も違ってきます。
まとめ• 立体異性体にはエナンチオマーやジアステレオマーがあります。
K殻はs軌道だけを保有します。
かがくののおと
窒素は原子番号7であるため、まわりに電子を5つ持ちます。
このスライドの意味するところは、「分子を作るときは、価電子が存在する殻の軌道を原則全部使って、一番安定になるような構造が選ばれる。
s軌道は1つだけ存在しますが、p軌道は3つ存在します。
sp3混成軌道、sp2混成軌道、sp混成軌道を考える時にはスピンを理解する必要があります。
- 関連記事
2021 tmh.io



xは、ジボランB2H6と過剰のアンモニアの高温反応で得られる無機ベンゼン(ボラジン)と言われるボラゾールB3N3H6を縮合するか、ホウ砂と塩化アンモニウムを過熱すると得られる白色脂肪状難溶性の粉末で、常圧では3000Cで昇華し、加圧下では3000Cで融解する。六方晶系グラファイト構造に似て(h-BNと云われる)、面内でのB-N間距離は1.45+Åで2重結合性がある(B-N単結合は1.60+Å)。面間は3.30+Åである。結合にはB%2B•.jpg)